Actiq 1200 Mikrogramm Lutschtablette

Downloads
Schulungsmaterial
Telefon: 0800 800 5022
Dieses Präparat ist rezeptflichtig.
Um weitere Informationen zum Produkt zu erhalten, loggen Sie sich bitte mit Ihren Zugangsdaten für
Fachkreise ein.
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
Actiq 200 Mikrogramm Lutschtablette,
gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
Actiq 400 Mikrogramm Lutschtablette,
gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
Actiq 600 Mikrogramm Lutschtablette,
gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
Actiq 800 Mikrogramm Lutschtablette,
gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
Actiq 1200 Mikrogramm Lutschtablette,
gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
Actiq 1600 Mikrogramm Lutschtablette,
gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
Wirkstoff: Fentanyl
| Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
|
Was in dieser Packungsbeilage steht
1. Was ist Actiq und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Actiq beachten?
3. Wie ist Actiq anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Actiq aufzubewahren?
6. Inhalt der Packung und weitere Informationen
Actiq enthält den Wirkstoff Fentanyl, ein starkes Schmerzmittel, das als Opioid bezeichnet wird. Actiq besteht aus einer Lutschtablette, die an einem Stiel befestigt ist.
- Actiq wird zur Behandlung von Durchbruchschmerzen bei erwachsenen Krebspatienten und jugendlichen Krebspatienten ab 16 Jahren angewendet, die gegen ihre chronischen (andauernden) Tumorschmerzen bereits andere Opioid-Schmerzmittel anwenden. Durchbruchschmerzen sind zusätzliche Schmerzen, die plötzlich auftreten, obwohl Sie Ihre gewohnten Opioid-Schmerzmittel eingenommen/angewendet haben.
Actiq darf NICHT angewendet werden,
- wenn Sie zur Behandlung Ihrer Dauerschmerzen nicht regelmäßig ein verordnetes Opioid (z. B. Codein, Fentanyl, Hydromorphon, Morphin, Oxycodon, Pethidin) jeden Tag nach einem festen Dosierplan über mindestens eine Woche eingenommen haben. Wenn Sie diese Arzneimittel nicht erhalten haben, dürfen Sie Actiq nicht anwenden, da dies ansonsten das Risiko für eine gefährlich verlangsamte und/oder flache Atmung oder sogar einen Atemstillstand erhöhen kann.
- wenn Sie allergisch gegen Fentanyl oder einen der in Abschnitt 6 genannten sonstigen Bestandteile dieses Arzneimittels sind.
- wenn Sie momentan Monoaminoxidase (MAO)-Hemmer, bestimmte Arzneimittel gegen schwere Depressionen, einnehmen oder in den vergangenen 2 Wochen eingenommen haben siehe Abschnitt 2 „Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, BEVOR Sie Actiq anwenden“).
- wenn Sie ein Arzneimittel einnehmen, das Natriumoxybat enthält.
- wenn Sie unter schweren Atemproblemen oder einer schweren Lungenerkrankung mit einer Einengung der Atemwege leiden.
- wenn Sie unter kurzzeitigem Schmerz, aber keinem Durchbruchschmerz leiden (z. B. Schmerzen aufgrund von Verletzungen, Operationen, Kopfschmerzen oder Migräne).
Wenden Sie Actiq NICHT an, wenn eine der oben genannten Situationen auf Sie zutrifft. Wenn Sie sich nicht sicher sind, fragen Sie Ihren Arzt oder Apotheker VOR der Anwendung von Actiq um Rat.
Warnhinweise und Vorsichtsmaßnahmen
Wenden Sie das Opioid-Schmerzmittel, das Sie bereits gegen Ihre chronischen (andauernden) Schmerzen einnehmen, während der Behandlung mit Actiq weiter an.
Bewahren Sie dieses Arzneimittel an einem sicheren und geschützten Ort auf, zu dem andere Personen keinen Zugang haben (siehe Abschnitt 5 „Wie ist Actiq aufzubewahren?“ für weitere Informationen).
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, BEVOR Sie Actiq anwenden:
- Wenn die Behandlung mit Ihrem anderen Opioid-Schmerzmittel, das Sie gegen Ihre chronischen (andauernden) Schmerzen einnehmen, noch nicht richtig eingestellt ist.
- Wenn Sie an einer Krankheit leiden, die Ihre Atmung beeinflusst (z. B. Asthma, pfeifende Atmung oder Kurzatmigkeit).
- Wenn Sie eine Kopfverletzung haben oder Bewusstlosigkeit erlitten haben.
- Wenn Sie Herzprobleme haben, insbesondere bei einem langsamen Herzschlag.
- Wenn Sie Leber- oder Nierenprobleme haben, da dadurch der Abbau des Arzneimittels in Ihrem Körper beeinflusst wird.
- Wenn Sie einen niedrigen Blutdruck aufgrund eines geringen Flüssigkeitsvolumens in Ihrem Kreislauf haben.
- Wenn Sie Diabetes haben.
- Wenn Sie über 65 Jahre alt sind – in diesem Fall werden Sie möglicherweise eine niedrigere Dosierung benötigen, und alle Dosiserhöhungen werden sehr sorgfältig von Ihrem Arzt überprüft.
- Wenn Sie Benzodiazepine einnehmen (siehe Abschnitt 2 unter „Anwendung von Actiq zusammen mit anderen Arzneimitteln“); die Anwendung von Benzodiazepinen kann die Wahrscheinlichkeit schwerwiegender Nebenwirkungen bis hin zum Tod erhöhen.
- Wenn Sie Antidepressiva oder Antipsychotika einnehmen (SSRIs [selektive Serotonin-Wiederaufnahme-Hemmer], SNRIs [Serotonin-Noradrenalin-Wiederaufnahmehemmer], MAO[Monoaminooxidase]-Hemmer; siehe Abschnitt 2 unter „Actiq darf nicht angewendet werden“ und „Anwendung von Actiq zusammen mit anderen Arzneimitteln“); die Anwendung solcher Arzneimittel zusammen mit Actiq kann zum Serotonin-Syndrom, einem möglicherweise lebensbedrohlichen Zustand, führen (siehe Abschnitt 2 unter „Anwendung von Actiq zusammen mit anderen Arzneimitteln“).
- Wenn Sie jemals Opioide oder andere Arzneimittel, Alkohol oder illegale Drogen missbraucht haben oder von diesen abhängig waren.
- Wenn bei Ihnen während der Anwendung von Opioiden jemals eine Nebenniereninsuffizienz, eine Störung, bei der die Nebennieren nicht mehr ausreichend Hormone produzieren, oder ein Mangel an Geschlechtshormonen (Androgenmangel) aufgetreten ist; (siehe Abschnitt 4 „Schwerwiegende Nebenwirkungen“).
- Wenn Sie Alkohol trinken; lesen Sie bitte den Abschnitt „Anwendung von Actiq zusammen mit Nahrungsmitteln, Getränken und Alkohol“.
Wenden Sie sich in folgenden Fällen noch WÄHREND der Anwendung von Actiq an Ihren Arzt:
- Wenn Sie an Schmerzen oder erhöhter Schmerzempfindlichkeit (Hyperalgesie) leiden, die nicht auf eine von Ihrem Arzt verordnete höhere Dosis Ihres Arzneimittels ansprechen.
- Wenn Sie Anzeichen von Zahnfäule (Karies) haben. Actiq enthält etwa 2 Gramm Zucker; die häufige Anwendung erhöht das Risiko von Zahnfäule, welche auch schwerwiegend sein kann. Es ist wichtig, dass Sie während der Behandlung mit Actiq auf eine gute Zahnpflege achten. Gehen Sie während der Behandlung regelmäßig zum Zahnarzt.
- wenn Sie eine Kombination der folgenden Symptome bemerken: Übelkeit, Erbrechen, Appetitlosigkeit, Ermüdung, Schwäche, Schwindelgefühl und niedriger Blutdruck. Zusammen könnten diese Symptome auf eine Nebenniereninsuffizienz hinweisen, eine potenziell lebensbedrohliche Störung, bei der die Nebennieren nicht mehr ausreichend Hormone produzieren.
- Schlafbezogene Atemstörungen: Actiq kann schlafbezogene Atemstörungen, wie Schlafapnoe (Atemaussetzer während des Schlafes) und schlafbezogene Hypoxämie (niedriger Sauerstoffgehalt des Blutes), verursachen. Zu den Symptomen können Atemaussetzer während des Schlafes, nächtliches Erwachen wegen Kurzatmigkeit, Durchschlafstörungen oder übermäßige Schläfrigkeit während des Tages gehören. Wenn Sie selbst oder eine andere Person diese Symptome beobachten, wenden Sie sich an Ihren Arzt. Ihr Arzt wird eine Verminderung der Dosis in Betracht ziehen.
Langzeitanwendung und Gewöhnung
Dieses Arzneimittel enthält Fentanyl, ein Schmerzmittel aus der Gruppe der Opioide. Die wiederholte Anwendung von Opioidschmerzmitteln kann dazu führen, dass das Arzneimittel weniger wirksam ist (d. h., Sie gewöhnen sich daran; dies wird als Arzneimitteltoleranz bezeichnet). Bei der Anwendung von Actiq können Sie auch schmerzempfindlicher werden. Dies wird als Hyperalgesie bezeichnet. Eine Erhöhung der Actiq-Dosis kann helfen, die Schmerzen eine Zeit lang zu reduzieren, sie kann Ihnen aber auch schaden. Sprechen Sie mit Ihrem Arzt, wenn Sie feststellen, dass Ihr Arzneimittel weniger wirksam wird. Ihr Arzt wird entscheiden, ob es für Sie besser ist, die Dosis zu erhöhen oder Ihre Anwendung von Actiq schrittweise zu verringern.
Abhängigkeit und Sucht
| Dieses Arzneimittel enthält das Opioid Fentanyl. Es kann abhängig und/oder süchtig machen. |
Die wiederholte Anwendung von Actiq kann auch zu Abhängigkeit, Missbrauch und Sucht führen, was wiederum zu einer lebensbedrohlichen Überdosierung führen kann. Das Risiko für solche Nebenwirkungen kann mit höherer Dosis und längerer Anwendungsdauer zunehmen. Abhängigkeit oder Sucht können dazu führen, dass Sie das Gefühl haben, nicht mehr die Kontrolle darüber zu besitzen, wie viel Arzneimittel Sie anwenden müssen oder wie oft. Möglicherweise haben Sie das Gefühl, dass Sie Ihr Arzneimittel weiterhin anwenden müssen, auch wenn es nicht hilft, Ihre Schmerzen zu lindern.
Das Risiko, abhängig oder süchtig zu werden, ist von Person zu Person unterschiedlich. Sie können ein höheres Risiko haben, von Actiq abhängig oder danach süchtig zu werden, wenn
- Sie oder jemand in Ihrer Familie schon einmal Alkohol, verschreibungspflichtige Arzneimittel oder illegale Drogen missbraucht hat oder davon abhängig war („Sucht“).
- Sie Raucher sind.
- Sie schon einmal psychische Probleme (Depression, Angst oder eine Persönlichkeitsstörung) hatten oder wegen anderer psychischer Erkrankungen von einem Psychiater behandelt wurden.
Wenn Sie während der Anwendung von Actiq eines der folgenden Anzeichen bemerken, könnte dies ein Hinweis darauf sein, dass Sie abhängig oder süchtig geworden sind.
- Sie müssen das Arzneimittel länger anwenden, als von Ihrem Arzt empfohlen wurde.
- Sie müssen mehr als die empfohlene Dosis anwenden.
- Sie wenden das Arzneimittel aus anderen Gründen an, als den Gründen wegen denen es Ihnen verschrieben wurde, z. B., „um ruhig zu bleiben“ oder „um schlafen zu können“.
- Sie haben wiederholt erfolglos versucht, die Anwendung des Arzneimittels zu beenden oder zu kontrollieren.
- Wenn Sie die Anwendung des Arzneimittels stoppen, fühlen Sie sich unwohl (z. B. Übelkeit, Erbrechen, Durchfall, Angstzustände, Schüttelfrost, Zittern und Schwitzen) und Sie fühlen sich besser, wenn Sie das Arzneimittel wieder anwenden („Entzugssymptome“).
Wenn Sie eines dieser Anzeichen bemerken, besprechen Sie mit Ihrem Arzt den besten Behandlungsweg für Sie, einschließlich der Frage, wann Sie aufhören sollten es anzuwenden und wie Sie dies sicher tun können.
Suchen Sie in folgenden Fällen DRINGEND einen Arzt auf:
- Wenn Sie während der Anwendung von Actiq Symptome wie Atemschwierigkeiten oder Schwindel, ein Anschwellen der Zunge, der Lippen oder im Hals bemerken; dies könnten frühe Symptome einer schwerwiegenden allergischen Reaktion sein (Anaphylaxis, Hypersensitivität; siehe Abschnitt 4 unter „Schwerwiegende Nebenwirkungen“).
Kinder und Jugendliche
Actiq wird für die Anwendung bei Kindern und Jugendlichen unter 16 Jahren nicht empfohlen.
Anwendung von Actiq zusammen mit anderen Arzneimitteln
Wenden Sie dieses Arzneimittel nicht an und informieren Sie Ihren Arzt oder Apotheker,
- Wenn Sie andere Fentanyl-Präparate einnehmen, die Ihnen in der Vergangenheit bereits gegen Ihre Durchbruchschmerzen verschrieben wurden; wenn Sie noch solche Fentanyl-Präparate zu Hause haben, informieren Sie sich bitte bei Ihrem Apotheker, wie diese zu entsorgen sind.
- Wenn Sie Monoaminoxidase(MAO)-Hemmer (Arzneimittel gegen schwere Depressionen) anwenden oder in den letzten 2 Wochen eingenommen haben (siehe Abschnitt 2 „Actiq darf NICHT angewendet werden“ und „Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, BEVOR Sie Actiq anwenden:“).
Informieren Sie Ihren Arzt oder Apotheker bevor Sie Actiq anwenden, wenn Sie andere Arzneimittel einnehmen/anwenden, kürzlich andere Arzneimittel eingenommen/angewendet haben oder beabsichtigen andere Arzneimittel einzunehmen/anzuwenden auch wenn es sich um nicht verschreibungspflichtige oder pflanzliche Arzneimittel handelt.
Es ist besonders wichtig, dass Sie Ihren Arzt oder Apotheker informieren, wenn Sie eines der folgenden Arzneimittel anwenden:
- Die gleichzeitige Anwendung von Actiq und Beruhigungsmitteln wie Benzodiazepine oder verwandte Arzneimittel erhöht das Risiko für Schläfrigkeit, Atembeschwerden (Atemdepression), Koma und kann lebensbedrohlich sein. Aus diesem Grund sollte die gleichzeitige Anwendung nur in Betracht gezogen werden, wenn es keine anderen Behandlungsmöglichkeiten gibt.
Wenn Ihr Arzt jedoch Actiq zusammen mit sedierenden Arzneimitteln verschreibt, sollten die Dosis und die Dauer der begleitenden Behandlung von Ihrem Arzt begrenzt werden.
Bitte informieren Sie Ihren Arzt über alle sedierenden Arzneimittel, (wie z. B. Schlaftabletten, Arzneimittel zur Behandlung von Angstzuständen, manche Arzneimittel zur Behandlung von allergischen Reaktionen (Antihistaminika) oder Beruhigungsmittel die Sie einnehmen und halten Sie sich genau an die Dosierungsempfehlung Ihres Arztes. Es könnte hilfreich sein, Freunde oder Verwandte darüber zu informieren, bei Ihnen auf die oben genannten Anzeichen und Symptome zu achten. Kontaktieren Sie Ihren Arzt, wenn solche Symptome bei Ihnen auftreten.
- Manche Muskelrelaxanzien (Arzneimittel gegen Muskelverspannungen) – wie z. B. Baclofen, Diazepam (siehe auch den Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“).
- Alle Arzneimittel, die den Abbau von Actiq in Ihrem Körper beeinflussen können – wie z. B. Ritonavir oder andere Arzneimittel zur Behandlung einer HIV-Infektion, andere sogenannte „CYP3A4-Inhibitoren“ – wie z. B. Ketoconazol, Itraconazol oder Fluconazol (Arzneimittel gegen Pilzinfektionen) und Troleandomycin, Clarithromycin oder Erythromycin (Arzneimittel gegen bakterielle Infektionen), und sogenannte „CYP3A4-Induktoren“ wie z. B. Rifampicin oder Rifabutin (Arzneimittel gegen bakterielle Infektionen), Carbamazepin, Phenobarbital oder Phenytoin (Arzneimittel zur Behandlung von Krampfanfällen).
- Eine bestimmte Art starker Schmerzmittel, sogenannte partielle Agonisten/Antagonisten, z. B. Buprenorphin, Nalbuphin und Pentazocin. Während der Anwendung dieser Arzneimittel könnten bei Ihnen Symptome eines Entzugssyndroms (Übelkeit, Erbrechen, Durchfall, Angst, Schüttelfrost, Zittern und Schwitzen) auftreten.
- Einige Schmerzmittel gegen Nervenschmerzen (Gabapentin und Pregabalin).
- Serotonerge Arzneimittel zur Behandlung von Depressionen (Antidepressiva: z. B. selektive Serotonin-Wiederaufnahmehemmer [SSRI] und Serotonin-Noradrenalin-Wiederaufnahmehemmer [SNRI]) oder Antipsychotika. Die Anwendung dieser Arzneimittel zusammen mit Actiq kann zu einem Serotonin-Syndrom – einer unter Umständen lebensbedrohenden Erkrankung – führen (siehe Abschnitt 2 „Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, BEVOR Sie Actiq anwenden:“ und „Actiq darf NICHT angewendet werden:“). Symptome des Serotonin-Syndroms sind: Veränderungen der psychischen Verfassung (z. B. Erregtheit, Halluzinationen, Koma) und anderen Wirkungen wie eine Körpertemperatur über 38 °C, eine Beschleunigung des Herzschlags, einen instabilen Blutdruck sowie gesteigerte Reflexe, Muskelsteife, Koordinationsmangel und/oder gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall) kommen. Ihr Arzt wird Ihnen mitteilen, ob Actiq für Sie geeignet ist.
Wenn Ihnen eine Operation unter Vollnarkose bevorsteht, sprechen Sie mit Ihrem Arzt oder dem medizinischen Fachpersonal.
Anwendung von Actiq zusammen mit Nahrungsmitteln, Getränken und Alkohol
- Actiq kann vor oder nach den Mahlzeiten angewendet werden. Wenden Sie Actiq jedoch nicht während der Mahlzeiten an.
- Vor der Anwendung von Actiq können Sie etwas Wasser trinken, um Ihren Mund anzufeuchten. Während der Anwendung von Actiq dürfen Sie jedoch nichts trinken oder essen.
- Sie dürfen während der Behandlung mit Actiq keinen Grapefruitsaft trinken. Grapefruitsaft kann den Abbau von Actiq in Ihrem Körper beeinflussen.
- Trinken Sie keinen Alkohol während der Anwendung von Actiq. Alkohol kann das Risiko ernster Nebenwirkungen (einschließlich Tod) erhöhen.
Schwangerschaft und Stillzeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
Schwangerschaft
Actiq sollte während der Schwangerschaft nur angewendet werden, wenn Sie dies mit Ihrem Arzt besprochen haben.
Wenn Actiq während der Schwangerschaft über einen längeren Zeitraum angewendet wird, besteht außerdem ein Risiko, dass beim neugeborenen Kind Entzugssymptome auftreten, die lebensbedrohlich sein können, wenn sie nicht erkannt und ärztlich behandelt werden, (siehe Abschnitt 4 „Andere Nebenwirkungen, Häufigkeit nicht bekannt“).
Sie sollten Actiq nicht während der Geburt anwenden, da Fentanyl beim Neugeborenen Atemschwierigkeiten verursachen kann.
Stillzeit
Fentanyl geht in die Muttermilch über und kann beim Säugling Nebenwirkungen hervorrufen. Wenden Sie Actiq nicht an falls Sie stillen. Sie sollten das Stillen frühestens 5 Tage nach der letzten Dosis von Actiq wieder beginnen.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Dieses Arzneimittel kann Ihre Fähigkeit einschränken ein Fahrzeug zu führen oder Werkzeuge oder Maschinen zu bedienen. Fragen Sie Ihren Arzt, ob es sicher ist, wenn Sie in den ersten Stunden nach der Anwendung von Actiq ein Fahrzeug führen oder Werkzeuge oder Maschinen bedienen.
Sie dürfen sich nicht an das Steuer eines Fahrzeugs setzen und keine Werkzeuge oder Maschinen bedienen, wenn Sie sich schläfrig oder schwindelig fühlen; verschwommen oder doppelt sehen; Konzentrationsschwierigkeiten haben.
Es ist wichtig, dass Sie wissen, wie Sie auf Actiq reagieren, bevor Sie sich an das Steuer eines Fahrzeugs setzen oder Werkzeuge oder Maschinen bedienen.
Actiq enthält Glucose
Enthält 1,89 g Glucose pro Dosis. Dies ist bei Patienten mit Diabetes mellitus zu berücksichtigen.
Bitte wenden Sie dieses Arzneimittel erst nach Rücksprache mit Ihrem Arzt an, wenn Ihnen bekannt ist, dass Sie unter einer Zuckerunverträglichkeit leiden.
Kann schädlich für die Zähne sein.
Actiq enthält Sucrose
Bitte wenden Sie dieses Arzneimittel erst nach Rücksprache mit Ihrem Arzt an, wenn Ihnen bekannt ist, dass Sie unter einer Zuckerunverträglichkeit leiden.
Kann schädlich für die Zähne sein.
Actiq enthält Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Lutschtablette, d. h. es ist nahezu „natriumfrei“.
Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt oder Apotheker an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind.
Vor Beginn der Behandlung und regelmäßig während der Behandlung wird Ihr Arzt außerdem mit Ihnen besprechen, was Sie von der Anwendung von Actiq erwarten können, wann und wie lange Sie es anwenden müssen, wann Sie Ihren Arzt kontaktieren sollten und wann sie aufhören müssen, es anzuwenden (siehe auch Abschnitt 2).
Bei der ersten Anwendung von Actiq wird Ihr Arzt mit Ihnen gemeinsam nach der Dosis suchen, die Ihre Durchbruchschmerzen lindern kann. Es ist sehr wichtig, dass Sie sich bei der Anwendung von Actiq genau an die Anweisungen Ihres Arztes halten.
- Ändern Sie nicht eigenmächtig die Dosierung von Actiq oder Ihren anderen Schmerzmitteln. Dosisänderungen müssen vom Arzt angeordnet und überprüft werden.
- Bitte sprechen Sie mit Ihrem Arzt, wenn Sie sich bezüglich der richtigen Dosis nicht sicher sind, oder wenn Sie Fragen zur Anwendung dieses Arzneimittels haben.
Wie das Arzneimittel in Ihren Körper gelangt
Sobald Sie die Lutschtablette in den Mund legen:
- Löst sich die Lutschtablette auf und der Wirkstoff wird freigesetzt. Dieser Vorgang dauert ca. 15 Minuten.
- Der Wirkstoff wird über die Mundschleimhaut in die Blutbahn aufgenommen.
Durch diese Art der Anwendung kann der Arzneistoff schnell aufgenommen werden. Somit werden Ihre Durchbruchschmerzen schnell gelindert.
Während die richtige Dosierung bestimmt wird
Bei der Anwendung von Actiq sollten Sie schnell eine gewisse Linderung spüren. Während Sie zusammen mit Ihrem Arzt die richtige Dosis ermitteln, die Ihre Durchbruchschmerzen wirksam lindern kann, kann es vorkommen, dass Sie auch 30 Minuten nach Anbruch der Actiq-Lutschtablette (15 Minuten nach Aufbrauchen der Actiq-Lutschtablette) noch keine ausreichende Schmerzlinderung verspüren. In diesem Fall wird Ihr Arzt Ihnen möglicherweise erlauben, für die weitere Behandlung dieser Durchbruchschmerzattacke eine zweite Actiq-Lutschtablette der gleichen Stärke anzuwenden. Wenden Sie nur auf ausdrückliche Anordnung des Arztes eine zweite Lutschtablette an. Sie dürfen niemals mehr als zwei Lutschtabletten zur Behandlung einer einzelnen Durchbruchschmerzattacke anwenden.
Während der Dosisfindung haben Sie möglicherweise gleichzeitig mehrere Stärken der Actiq-Lutschtabletten bei sich zu Hause. Behalten Sie immer nur die Stärken, die Sie zu Hause benötigen. Dies dient zur Vermeidung von Verwechslungen oder einer versehentlichen Überdosierung. Sprechen Sie mit Ihrem Apotheker über die Entsorgung ungebrauchter Actiq-Lutschtabletten.
Wie viele Lutschtabletten Sie anwenden sollten
Sobald zusammen mit Ihrem Arzt die richtige Dosierung gefunden wurde, verwenden Sie eine Lutschtablette pro Durchbruchschmerzattacke. Informieren Sie Ihren Arzt, wenn die für Sie ermittelte Dosierung Ihre Durchbruchschmerzen für mehrere Durchbruchschmerzattacken in Folge nicht lindert. Ihr Arzt wird dann entscheiden, ob Ihre Dosierung verändert werden muss.
Sie müssen unverzüglich Ihren Arzt informieren, wenn Sie Actiq häufiger als viermal pro Tag anwenden, da dann möglicherweise eine Änderung Ihres Behandlungsschemas erforderlich ist. Ihr Arzt kann die Behandlung gegen Ihre Dauerschmerzen ändern. Wenn Ihre Dauerschmerzen wieder unter Kontrolle gebracht sind, muss Ihr Arzt möglicherweise die Dosis für Actiq ändern. Wenn Ihr Arzt eine von Actiq verursachte erhöhte Schmerzempfindlichkeit („Hyperalgesie“) feststellt, muss Ihre Dosis von Actiq möglicherweise verringert werden (siehe Abschnitt 2 unter „Warnhinweise und Vorsichtsmaßnahmen“). Um eine möglichst effektive Linderung zu erfahren, informieren Sie Ihren Arzt über Ihre Schmerzen und wie Actiq bei Ihnen wirkt, so dass die Dosis erforderlichenfalls angepasst werden kann.
Wie Sie das Arzneimittel anwenden
Öffnen der Packung
- Jede Actiq-Lutschtablette ist in einer eigenen Blisterpackung versiegelt.
- Öffnen Sie die Packung erst, wenn Sie bereit zur Anwendung sind. Öffnen Sie die Packung nicht im Voraus.
- Halten Sie die Blisterpackung so, dass die bedruckte Seite von Ihnen weg zeigt.
- Greifen Sie das kurze Laschenende der Blisterpackung.
- Setzen Sie die Schere nahe beim Ende der Actiq-Lutschtablette an und schneiden Sie das Ende mit der langen Lasche knapp oberhalb der Lutschtablette mit der Schere vollständig ab (siehe Abbildung).
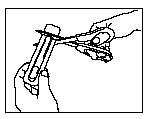
- Trennen Sie die bedruckte Rückseite von der Blisterpackung und ziehen Sie sie vollständig von der Blisterpackung ab.
- Entnehmen Sie die Actiq-Lutschtablette aus der Blisterpackung, und legen Sie sie sofort in den Mund.
Anwendung der Actiq-Lutschtablette
- Legen Sie die Lutschtablette zwischen Wange und Zahnfleisch.
- Greifen Sie die Lutschtablette am Stiel und bewegen Sie sie kontinuierlich in Ihrem Mund hin und her. Streichen Sie dabei insbesondere an den Wangen entlang. Drehen Sie den Stiel häufig.
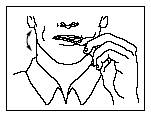
- Um die optimale Schmerzlinderung zu erreichen, sollten Sie die Dosiereinheit innerhalb von 15 Minuten vollständig aufbrauchen. Wenn Sie Actiq zu schnell aufbrauchen, schlucken Sie eine zu große Menge des Arzneimittels und Ihre Durchbruchschmerzen werden weniger gut gelindert.

- Sie dürfen die Lutschtablette nicht zerbeißen oder kauen; dies würde zu geringeren Blutspiegeln und weniger Schmerzlinderung führen als bei bestimmungsgemäßer Anwendung.
- Wenn Sie aus irgendeinem Grund bei jeder Durchbruchschmerzattacke die Lutschtablette nicht vollständig aufbrauchen, sprechen Sie bitte mit Ihrem Arzt.
Wie oft Sie Actiq anwenden sollten
Sobald eine Dosis ermittelt ist, mit der Ihre Schmerzen wirksam behandelt werden können, sollten Sie nicht mehr als vier Actiq-Lutschtabletten pro Tag anwenden. Wenn Sie denken, dass Sie mehr als vier Actiq-Lutschtabletten pro Tag benötigen, sprechen Sie bitte sofort mit Ihrem Arzt.
Wie viele Actiq-Lutschtabletten Sie anwenden sollten
Verwenden Sie nicht mehr als zwei Dosiereinheiten zur Behandlung einer einzelnen Durchbruchschmerzattacke.
Wenn Sie eine größere Menge von Actiq angewendet haben, als Sie sollten
- Die häufigsten Nebenwirkungen bei einer Überdosierung sind Schläfrigkeit, Übelkeit oder Schwindel. Wenn Sie sich schwindelig fühlen, Ihnen übel wird oder Sie sich sehr schläfrig fühlen, bevor die Lutschtablette vollständig aufgelöst ist, nehmen Sie sie aus Ihrem Mund heraus und bitten eine andere Person in Ihrem Haushalt um Hilfe.
- Eine schwerwiegende Nebenwirkung von Actiq ist eine verlangsamte und/oder flache Atmung. Dies kann auftreten, wenn die Dosierung von Actiq für Sie zu hoch ist oder wenn Sie Actiq zu oft anwenden. In schwerwiegenden Fällen kann die Anwendung von zu viel Actiq auch zu einem Koma führen. Wenn Sie sich sehr schwindlig oder sehr schläfrig fühlen oder eine langsame oder flache Atmung haben, nehmen Sie bitte unverzüglich medizinische Hilfe in Anspruch.
- Eine Überdosierung kann auch zu einer Erkrankung des Gehirns führen, die als toxische Leukenzephalopathie bezeichnet wird.
Was zu tun ist, wenn ein Kind oder Erwachsener Actiq versehentlich anwendet
Wenn Sie glauben, dass jemand Actiq versehentlich angewendet hat, rufen Sie bitte sofort den medizinischen Notdienst. Versuchen Sie, die Person wach zu halten (indem Sie ihren Namen rufen und sie am Arm oder an der Schulter schütteln), bis der Notdienst eintrifft.
Wenn Sie die Anwendung von Actiq vergessen haben
Wenn Ihre Durchbruchschmerzen noch andauern, können Sie Actiq wie von Ihrem Arzt verordnet anwenden. Wenn der Durchbruchschmerz aufgehört hat, wenden Sie Actiq bitte erst wieder bei der nächsten Durchbruchschmerzattacke an.
Wenn Sie die Anwendung von Actiq abbrechen
Sie sollten Actiq absetzen, wenn bei Ihnen keine Durchbruchschmerzen mehr auftreten. Sie müssen jedoch weiterhin Ihre üblichen schmerzstillenden Opioid-Arzneimittel zur Behandlung Ihrer dauerhaften Tumorschmerzen nach Anweisung Ihres Arztes einnehmen. Nach Absetzen von Actiq könnten bei Ihnen Entzugssymptome auftreten, die den möglichen Nebenwirkungen von Actiq ähneln. Wenden Sie sich an Ihren Arzt, wenn bei Ihnen Entzugssymptome auftreten oder Sie Bedenken bezüglich der Schmerzlinderung haben. Ihr Arzt wird beurteilen, ob Sie Arzneimittel zur Verminderung oder Beseitigung der Entzugssymptome benötigen.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Informieren Sie bitte Ihren Arzt, wenn Sie eine der aufgeführten Nebenwirkungen bemerken.
Schwerwiegende Nebenwirkungen
- Die schwerwiegendsten Nebenwirkungen sind eine flache Atmung, niedriger Blutdruck und Schock.
Wenn Sie eine der folgenden schwerwiegenden Nebenwirkungen bemerken, sollten Sie oder Ihre Betreuungsperson die Actiq-Lutschtablette aus Ihrem Mund ENTFERNEN sowie sofort Ihren Arzt benachrichtigen und den medizinischen Notdienst rufen, da Sie möglicherweise umgehend ärztliche Hilfe benötigen: - Wenn Sie sehr schläfrig werden oder eine verlangsamte und/oder flache Atmung haben.
- Bei Atemschwierigkeiten oder Schwindelgefühl, Anschwellen von Zunge, Lippe oder Hals, was frühe Anzeichen auf eine schwere allergische Reaktion sein können.
Hinweis für Betreuungspersonen:
Wenn Sie beobachten, dass der Patient bei der Anwendung von Actiq langsam und/oder flach atmet, oder wenn Sie ihn nur schwer aufwecken können, ergreifen Sie SOFORT die folgenden Maßnahmen:
- Ziehen Sie die Actiq-Lutschtablette am Stiel aus dem Mund der Person und lagern Sie sie bis zur Entsorgung für Kinder und Haustiere unzugänglich.
- RUFEN SIE DEN MEDIZINISCHEN NOTDIENST.
- Wenn die Atmung der Person verlangsamt zu sein scheint, während Sie auf den medizinischen Notdienst warten, fordern Sie sie alle 5-10 Sekunden auf zu atmen.
Wenn Sie sich während der Anwendung von Actiq übermäßig schwindelig, schläfrig oder anderweitig krank fühlen, nehmen Sie die Lutschtablette am Stiel aus dem Mund heraus und entsorgen Sie sie gemäß den Anweisungen in dieser Gebrauchsinformation (siehe Abschnitt 5). Für weitere Anweisungen zur Anwendung von Actiq wenden Sie sich dann bitte an Ihren Arzt.
- Verständigen Sie Ihren Arzt, wenn bei Ihnen eine Kombination der folgenden Symptome auftritt:
Übelkeit, Erbrechen, Appetitlosigkeit, Müdigkeit, Schwäche, Schwindelgefühl und niedriger Blutdruck
Gemeinsam können diese Symptome ein Anzeichen für eine möglicherweise lebensbedrohende Erkrankung sein, die als Nebenniereninsuffizienz bezeichnet wird und bei der die Nebennieren nicht genug Hormone produzieren. - Bei längerfristiger Anwendung von Actiq während der Schwangerschaft besteht das Risiko von Entzugserscheinungen beim Neugeborenen die auch lebensbedrohend sein können (siehe Abschnitt 2 „Schwangerschaft und Stillzeit“).
Sonstige Nebenwirkungen
Sehr häufig: können mehr als 1 Behandelten von 10 betreffen
- Erbrechen, Übelkeit, Verstopfung, Magen-(Bauch-)Schmerzen
- Asthenie (Kraftlosigkeit), Schläfrigkeit, Schwindelgefühl, Kopfschmerzen
- Kurzatmigkeit
Häufig: können bis zu 1 von10 Behandelten betreffen
- Verwirrtheit, Angst, Sehen oder Hören von Dingen, die es nicht gibt (Halluzinationen), Depressionen, Stimmungsschwankungen
- Unwohlsein
- Muskelzuckungen, Schwindel, Bewusstlosigkeit, Ruhigstellung, Kribbeln oder Taubheit, Koordinationsstörungen, gesteigerte oder veränderte Empfindlichkeit gegenüber Berührungen, Konvulsionen (Krämpfe)
- Mundtrockenheit, Entzündungen der Mundschleimhaut, Zungenerkrankungen (z. B. Brennen oder Geschwüre), Geschmacksstörungen
- Blähungen, aufgetriebener Bauch, Verdauungsbeschwerden, verminderter Appetit, Gewichtsverlust
- Verschwommenes Sehen oder Doppeltsehen
- Schwitzen, Hautausschlag, Juckreiz
- Schwierigkeiten beim Wasserlassen
- Unfallbedingte Verletzungen (z. B. durch Stürze)
Gelegentlich: können bis zu 1 von 100 Behandelten betreffen
- Zahnverfall (der zu einer Zahnentfernung führen kann), Darmlähmung, Geschwüre der Mundschleimhaut, Zahnfleischbluten
- Koma, schleppende Sprache
- Albträume, Depersonalisierung (Unwirklichkeitsgefühl gegenüber sich selbst oder der Umgebung), Denkstörungen, Euphorie (übermäßiges Glücksgefühl)
- Erweiterung der Blutgefäße
- Nesselausschlag
Häufigkeit nicht bekannt
Über folgende Nebenwirkungen wurde ebenfalls während der Anwendung von Actiq berichtet, es ist jedoch nicht bekannt, wie häufig sie auftreten können:
- Zahnfleischschwund, Zahnfleischentzündung, Zahnverlust, schwere Atemprobleme, Hitzegefühl, starkes Wärmegefühl, Durchfall, Schwellungen an Armen oder Beinen, Ermüdung, Schlaflosigkeit, Fieber, Entzugssyndrom (kann sich durch das Auftreten folgender Nebenwirkungen äußern: Übelkeit, Erbrechen, Durchfall, Angst, Schüttelfrost, Zittern und Schwitzen)
- Mangel an Sexualhormonen (Androgenmangel)
- Arzneimittelabhängigkeit (Sucht) (siehe Abschnitt 2)
- Arzneimittelmissbrauch (siehe Abschnitt 2)
- Arzneimittelgewöhnung (siehe Abschnitt 2)
- Delirium (die Symptome können eine Kombination aus gesteigerter körperlicher Erregbarkeit [Agitiertheit], Unruhe, Orientierungsstörung, Verwirrtheit, Furcht, Sehen oder Hören von nicht vorhandenen Dingen, Schlafstörung und Alpträumen umfassen)
- Atemschwierigkeiten während des Schlafens
- Blutung an der Anwendungsstelle
Die längerfristige Behandlung mit Fentanyl in der Schwangerschaft kann beim Neugeborenen Entzugserscheinungen hervorrufen, die lebensbedrohlich sein können (siehe Abschnitt 2).
Während Sie Actiq anwenden, können Irritationen, Schmerzen und Geschwüre am Verabreichungsort und Zahnfleischbluten auftreten.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
Bewahren Sie dieses Arzneimittel an einem sicheren und geschützten Ort auf, zu dem andere Personen keinen Zugang haben. Es kann bei Personen, denen es nicht verschrieben wurde, schwere Schäden verursachen und tödlich wirken, wenn sie es versehentlich oder absichtlich anwenden oder einnehmen.
Der schmerzstillende Wirkstoff in Actiq ist sehr stark wirksam und könnte lebensbedrohlich sein, wenn er versehentlich von einem Kind eingenommen wird. Actiq muss für Kinder unzugänglich aufbewahrt werden.
- Sie dürfen Actiq nach dem auf der Blisterpackung und dem Umkarton angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
- Nicht über 30 ºC lagern.
- Lassen Sie Actiq immer so lange in der Blisterpackung, bis Sie bereit zur Anwendung sind. Sie dürfen Actiq nicht verwenden, wenn die Blisterpackung beschädigt oder geöffnet wurde.
- Wenn Sie Actiq nicht länger anwenden, oder wenn Sie ungebrauchte Actiq-Lutschtabletten zu Hause haben, bringen Sie alle ungebrauchten Packungen zu Ihrem Arzt oder Apotheker zurück.
Entsorgung von Actiq nach der Anwendung
Eine teilweise aufgebrauchte Actiq-Lutschtablette kann genug Wirkstoff enthalten, um für ein Kind gesundheitsschädlich oder lebensbedrohlich zu sein. Auch wenn nur noch wenig oder überhaupt kein Arzneimittel mehr auf dem Stiel zurückgeblieben ist, muss der Stiel selbst ordnungsgemäß wie folgt entsorgt werden:
- Wenn überhaupt keine Arzneimittelreste mehr vorhanden sind, werfen Sie den Stiel in einen Abfallbehälter, der für Kinder und Haustiere unzugänglich ist.
- Wenn auf dem Stiel noch Arzneimittelreste haften, halten Sie die Lutschtablette unter fließendes heißes Wasser, um die Reste aufzulösen und werfen den Stiel danach in einen Abfallbehälter, der für Kinder und Haustiere unzugänglich ist.
- Wenn Sie die Lutschtablette nicht vollständig aufgebraucht haben und die Arzneimittelreste nicht sofort auflösen können, lagern Sie die Lutschtablette für Kinder und Haustiere unzugänglich, bis Sie die teilweise aufgebrauchte Lutschtablette wie oben beschrieben entsorgen können.
- Spülen Sie die teilweise aufgebrauchte Lutschtablette, den Stiel oder die Blisterpackung nicht die Toilette herunter.
Was Actiq enthält
- Der Wirkstoff ist Fentanyl
Jede einzelne Lutschtablette enthält jeweils:- 200 Mikrogramm Fentanyl (als Citrat),
- 400 Mikrogramm Fentanyl (als Citrat),
- 600 Mikrogramm Fentanyl (als Citrat),
- 800 Mikrogramm Fentanyl (als Citrat),
- 1200 Mikrogramm Fentanyl (als Citrat),
- 1600 Mikrogramm Fentanyl (als Citrat).
- Die sonstigen Bestandteile sind:
Lutschtablette
Stärkehydrolysat (entspricht ca. 1,89 Gramm Glucose).
Citronensäure, Dinatriumhydrogenphosphat, künstliches Beerenaroma (Maltodextrin [enthält Glucose], Propylenglycol, künstliche Aromastoffe und Triethylcitrat), Magnesiumstearat
Essbarer Klebstoff zur Befestigung der Lutschtablette am Stiel
Poly-{O-[hydrogen-(oct-1-en-1-yl)succinyl]stärke}, Natriumsalz (E 1450), Puderzucker (Sucrose (Saccharose) und Maisstärke), Gereinigtes Wasser
Drucktinte
Gereinigtes Wasser, entwachster weißer Schellack, Brillantblau FCF (E 133), Ammoniumhydroxid (E 527) zur pH-Einstellung
Wie Actiq aussieht und Inhalt der Packung
Actiq besteht aus einer weißen bis cremefarbenen festen Lutschtablette zur Anwendung in der Mundhöhle, die an einem Stiel befestigt ist. Die Lutschtablette kann durch die Lagerung leicht gesprenkelt aussehen. Dies liegt an geringfügigen Veränderungen des Geschmacksstoffs im Produkt und beeinflusst in keiner Weise die Wirkung.
Actiq ist in sechs verschiedenen Stärken erhältlich: 200, 400, 600, 800, 1200 und 1600 Mikrogramm. Die Wirkstärke ist auf der weißen Lutschtablette, dem Stiel, der Blisterpackung und dem Karton angegeben, um sicherzustellen, dass Sie das richtige Arzneimittel anwenden. Jeder Stärke ist eine eigene Farbe zugeordnet.
Die Actiq Lutschtabletten sind in einzelnen Blisterpackungen verpackt.
Die Blisterpackungen sind in Umkartons zu 3 oder 30 einzelnen Actiq Dosiereinheiten verpackt.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer
TEVA GmbH
Graf-Arco-Str. 3
89079 Ulm
Deutschland
Hersteller
Merckle GmbH
Ludwig-Merckle-Straße 3
89143 Blaubeuren
Deutschland
Diese Packungsbeilage wurde zuletzt überarbeitet im März 2025.
Versionscode: Z19